Usando apenas as letras: A,B,L,O e T, quantas palavras diferentes é possível formar? Veja: BOLA, LOBO, TAL, BOLOTA, BATATA, LATA… Agora pense nos elementos químicos. São pouco mais de 100, e ao se combinarem, formam milhões de substâncias diferentes. Mas é importante saber que são as moléculas, não seus átomos componentes, que determinam as propriedades das substâncias. Todas esses fatos são caracterizados da Ligação Iônica.
Uma molécula caracteriza-se:
#Pela natureza dos átomos que a compõem;
#Pela reação de proporção entre esses átomos;
#Pelo arranjo dos átomos dentro dessa molécula.
Alguns elementos não se combinam naturalmente, seus átomos são encontrados isolados na natureza e constituem os gases nobres ou raros na atmosfera. Dê uma olhada na tabela periódica e confira se são estes: Hélio, neônio, argônio, criptônio, xenônio, e radônio. Compare a estrutura desses átomos com os demais, para descobrir uma forma pela qual eles se combinam.
Ligação Iônica – Explicação
Para a combinação dos átomos, a eletrosfera é importante. É através dos elétrons que os átomos se unem. Veja na tabela periódica a distribuição dos elétrons nas eletrosferas dos gases nobres. As eletrosferas dos átomos desses gases são estáveis. Os outros átomos tendem a adquirir eletrosferas iguais às dos gases nobres. Fazem isso, perdendo ou ganhando menor número possível de elétrons.
Os átomos eletricamente, são nêutrons, porque o número de prótons (+) é igual ao número de elétrons (-). Mas, ao ganhar ou perder elétrons, o átomo deixa de ser neutro. Se perder elétrons, que possuem carga negativa, fica com mais prótons, que possuem carga positiva. Logo ficará eletricamente positivo (+). Se ganhar elétrons, fica com mais elétrons do que prótons, ficando assim com carga negativa (-). Átomos eletricamente carregados, isto é, que ganharam ou perderam elétrons, são chamados de íons.
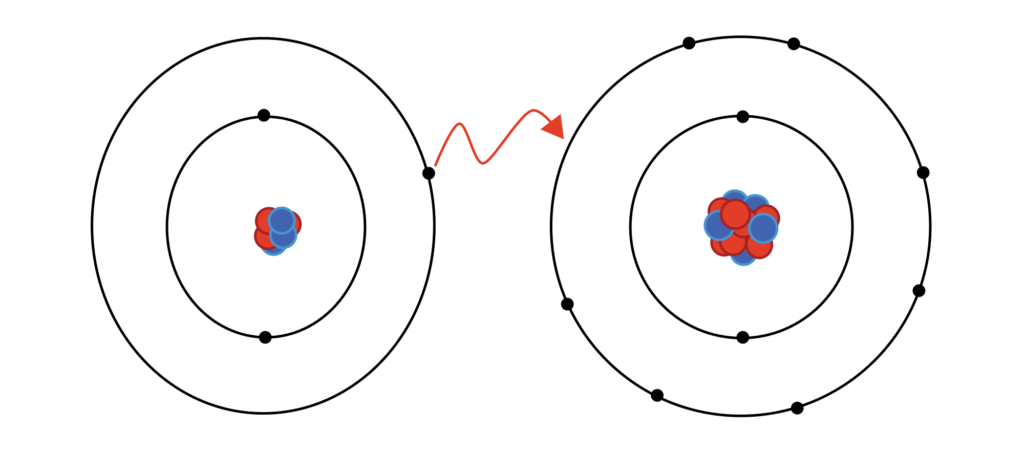
Volte à Tabela Periódica e observe o elemento cloro (CL). Ele está ao lado do argônio (Ar). Quantos elétrons o cloro possui? Para ficar com a eletrosfera igual à do argônio, o cloro precisa ganhar ou perder elétrons?Quantos?
Note que o cloro (CL) tem 17 elétrons na sua eletrosfera e o argônio, 18. O cloro, ganhando um elétron, sua eletrosfera fica igual à do argônio, e com isso adquire carga negativa, tornando-se um íon, representado por CL-.
Compare o sódio (Na) com o neônio (Ne). O sódio tem 11 elétrons e o neônio 10. O sódio perdendo um elétron, fica com a eletrosfera semelhante à do neônio, e com isso adquire carga positiva, tornando-se um íon com carga elétrica positiva, representado por Na+.
Ligação Iônica – Compostos
Os compostos resultantes da combinação entre íons são sempre neutros. Assim sendo, os íons positivos se combinam com íons negativos. Nesse caso, um íon de sódio (Na+) combina com um íon de cloro (Cl-) e forma um composto neutro= NaCl (Cloreto de sódio, que é o sal de cozinha).
Os compostos são representados pelas fórmulas. A fórmula nos diz quais os tipos de átomos e também a proporção deles. Por convenção, escreve-se em primeiro lugar o íon positivo. No caso dos O- combinarem com Na+, a fórmula será: Na2O.
As ligações entre íons são chamadas de ligações iônicas, formando um grupamento iônico. As substâncias resultantes de ligações eletrovalentes são chamadas de substâncias iônicas.