Você já sabe que os átomos tendem a adquirir eletrosfera semelhante à de gases nobres e conseguem isso combinando-se com outros átomos. Veja na tabela periódica o Hidrogênio. Quantos elétrons ele possui? Compare com o átomo de hélio, que é um gás nobre. Este conjunto de informações completam a constituição da Ligação Covalente.
Quando um átomo de hidrogênio se aproxima de outro átomo de hidrogênio, dois elétrons ficam próximos de cada núcleo: Um elétron de cada átomo. Tudo se passa como se cada átomo tivesse dois elétrons, isto é, os 2 elétrons passam a pertencer ao mesmo tempo aos dois átomos. Nesse caso, a eletrosfera fica semelhante à do gás hélio, que é um gás nobre e tem 2 elétrons.
Os 2 átomos que compartilham elétrons ficam unidos, formando uma molécula de hidrogênio. Esse tipo de ligação, ocorre através da compartilhação de elétrons, recebe o nome de Ligação Covalente ou Molecular. As substâncias resultantes dessas ligações recebem o nome de substâncias moleculares.
Pode-se representar de duas maneiras a molécula resultante dessa ligação: H-H ou H2
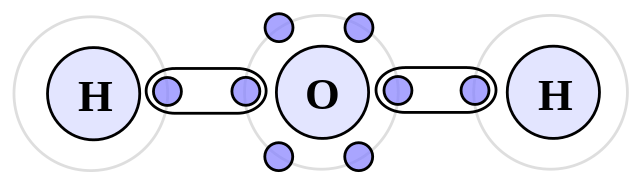
Ligação Covalente – Molécula de Água
Você sabe como é a molécula de água? Recordando, o oxigênio possui 8 elétrons. Para ficar com a eletrosfera semelhante ao neônio, precisa de mais 2 elétrons. O hidrogênio, que possui 1 elétron, precisa de mais 1 para ficar com a eletrosfera igual ao hélio.
Para formar a molécula de água, cada átomo de hidrogênio compartilha um par de elétrons com o átomo de oxigênio. Podemos representar de diversas maneiras a molécula de água:
Os gases nobres possuem eletrosferas estáveis. Os átomos, quando se unem, procuram estabelecer a estabilidade da eletrosfera dos gases nobres. Tanto na Ligação Iônica como na Covalente, os átomos tendem a adquirir eletrosferas semelhantes às dos gases nobres. Na covalente isso é feito compartilhando elétrons. Na ligação iônica é feito tornando-se íons, isto é, cedendo ou recebendo elétrons.
Ligação Covalente – Ligação Metálica
A ligação metálica ocorre principalmente entre metais. Nesse tipo de ligação química há perda de elétrons na última camada eletrônica. Nas ligações metálicas, os átomos são fracamente atraídos pelo núcleo de seus átomos, deslocando-se entre os diversos núcleos do grupo atômico. Os átomos perdem elétrons tornando-se cátions (íons +).
Como os elétrons dos íons possuem certa liberdade de movimento, isso torna os metais bons condutores de calor e eletricidade.