As leis das reações químicas são leis experimentais ou empíricas, isto é, resultam de experiências ou comprovações feitas em laboratório. Essas leis surgiram no fim do século XVIII e começo do século XIX. Historicamente, as leis apareceram antes das ideias de átomos, moléculas, fórmulas e equações químicas. Sendo assim, a equipe do Fato Curioso fará o possível para apresentar a Lei da conservação da massa .
As leis das reações químicas classificam-se em:
– Leis ponderais, que dizem respeito às massas;
– Leis volumétricas, que dizem respeito aos volumes gasosos – são as leis volumétricas de Gay-Lussac.
Lei da conservação da massa – A lei de Lavoisier
“Numa reação química, realizada em recipiente fechado, a soma das massas dos reagentes é igual à soma das massas dos produtos.”
Podemos comprovar experimentalmente a Lei de Lavoisier do seguinte modo:
Tomamos uma determinada massa de iodeto de potássio (por exemplo: 150g), dissolvemo-la em uma massa conhecida de água (por exemplo: 500g), obtendo desse modo uma solução límpida.
Em outro béquer, colocamos uma massa de nitrato de chumbo (por exemplo: 200g) e a dissolvemos em água (por exemplo: 500g), obtendo assim uma solução límpida.
A soma das massas das duas soluções preparadas é igual a 1350g.
Misturando as duas soluções em um único recipiente, ocorre a reação. A evidência prática que ocorreu reação é o aparecimento de um composto amarelo insolúvel. Passando o sistema após a reação, obteremos o valor de 1350g .
Verificamos então que a massa final é igual à massa inicial do conjunto, apesar da reação química aí verificada. É interessante notar que, durante séculos, a humanidade não teve a ideia de conservação da massa, simplesmente porque ninguém lembrava de “manter o recipiente fechado”; desse modo, os gases podiam “entrar” ou “sair” da reação, dando a impressão de que a massa do conjunto estaria aumentando ou diminuindo. Por exemplo, os antigos achavam que, durante a queima do carvão, o carvão sumia. Hoje nós explicamos o mesmo fenômeno da seguinte maneira:
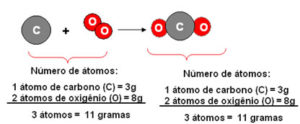
C (carvão)+O2 (do ar) -> CO2 (gás carbônico)
E podemos verificar experimentalmente que a soma das massas do carvão e do oxigênio (que é fornecido pelo ar) é igual à massa final do gás carbônico formado.
Lei da conservação da massa – Nada se perde, nada se cria, tudo se transforma
Quando se pensa na lei da conservação da massa, vem-nos a mente o nome Antoine Laurent de Lavoisier (1743-1794). Em 1789, foi publicado o famoso Traité Élémentaire de Chimie, de Lavoisier. É um livro que marcou época ao consolidar um processo conhecido como revolução química.
Lavoisier é considerado o pai da química moderna. Em parte, isso se deve à alta qualidade dos equipamentos e materiais usados, possibilitando-lhe medidas precisas, permitindo-lhe evitar falhas de interpretação em seus antecessores.